Dominika Macková, 2.ročník, LF UPJŠ
Ústna dutina človeka je domovom pre mnohé druhy baktérií. Môžu mať dopad pozitívny, ale aj negatívny. Z pohľadu zubného lekárstva sú jedny z najvýznamnejších kariogénne druhy (napr. S. mutans, S. sanguis, Actinomyces) prítomné v zubnom povlaku, ktoré napádajú tvrdé zubné tkanivá a tým spôsobujú zubný kaz. Posledné výskumy ale naznačujú, že isté patogény môžu poškodzovať aj okolité mäkké tkanivá, a to až do takej miery, že majú potenciál vyvolať rakovinu. Na závažnosti pridáva aj štúdia od doktora Michauda, podľa ktorej sú postihnutí pacienti trápiaci sa zápalovými ochoreniami, ako napríklad periodontitída, 2 až 5-krát vyšším rizikom rakoviny ústnej dutiny v porovnaní so zdravými ľuďmi.
V ústnej dutine sa nachádza vyše 700 druhov mikroorganizmov. Niektoré z nich sú prechodné(prijaté potravou alebo vdychovaným vzduchom), iné sa tam nachádzajú natrvalo, pričom mnohé majú svoje charakteristické miesto výskytu (podnebie, vestibulárna oblasť, jazyk). Pri zdravom jedincovi sú prospešné a škodlivé baktérie v rovnováhe a prispievajú k správnemu fungovaniu organizmu.
Periodontitída
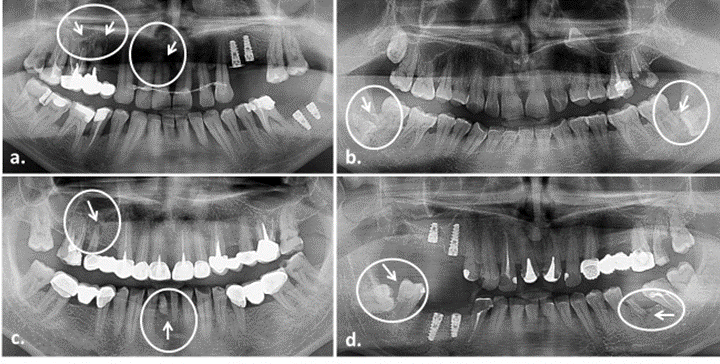
Ide o chronické zápalové ochorenie, postihujúce viac ako polovicu dospelej populácie. Vzniká ako dôsledok zanedbávania ústnej hygieny v gingiválnej tretine zuba. Tam sa nachádza priestor medzi gingívou a zubom, kde sa pri zlej hygiene usázda povlak. Baktérie v ňom prítomné rozleptávajú sklovinu na sklovinovo-cementovej hranici a spôsobujú zápal aj v okolitej gingíve. Ten sa presúva hlbšie, pri závažnejšom štádiu môže spôsobiť až krvácanie ďasien.
Bolo preukázané, že pri periodontickom náleze sa v mieste výskytu nachádza iné zloženie baktérií ako v zdravej ústnej dutine, konkrétne napríklad druhy Tannerella forsythia, Porphyromonas gingivalis, alebo Treponema denticola. Tieto periopatogénne baktérie vyvolávajú a udržujú chronickú infekciu, ktorej odpoveďou je zápal. Ich dopad je meraný hlavne prostredníctvom zvýšeného množstva leukocytov a cytokínov po prvotnej zápalovej odpovedi.
Bakteriálne mechanizmy podporujúce karcinogenézu
Látky produkované pri dlhodobom zápale(hlavne cytokíny a ich podkategórie, napríklad interleukíny) poškodzujú okolité tkanivo. Tieto zmeny môžu vyústiť až do permanentných genetických zmien, hlavne v epitelových bunkách. Pri dlhodobom neliečení sú tieto bunky vystavované škodlivým metabolitom, ktoré môžu vyvolať nekontrolované delenie buniek vedúce až ku karcinómu. Baktérie ale ešte k tomu môžu priamo ovplyvňovať bunkový cyklus, podporovať prežívanie buniek, aktivovať onkogenézu, redukovať expresiu proteínov umožňujúcich apoptózu (proteíny zapríčiňujúce programovanú bunkovú smrť), či zvýšiť migráciu buniek, dokonca podporiť metastázy.
Nádor pozostáva z 3 hlavných štádií: tumor, uzlík a metastáza. Bolo preukázané, že počas týchto štádií sa zloženie ústnej mikroflóry mení. V nádorových vzorkách podľa profesora Yanga bolo preukázané výrazne zvýšené množstvo baktérií rodu Peptostreptococcus, Fusobacterium, Prevotella, Porphyromonas a iných v porovnaní so zdravým tkanivom. Počas postupu rakoviny sa množstvo baktérií rodu Streptococcus, Haemophilus, Porphyromonas a Actinomyces znižuje, zatiaľ čo množstvo F. periodonticum, P. micra, S. constellatus, Haemophilus influenza, and Filifactor alocis sa zvyšuje so stupňom ochorenia. Dochádza k dysbióze, narúša sa rovnováha medzi baktériami. Podľa štúdie vydanej profesorom Zhangom sa predpokladá, že baktérie stimulujú tumorgenézu 3 mechanizmami: stimuláciou chronického zápalu, pôsobením ako činidlo proti apoptóze alebo tvorbou karcinogénnych látok.
Dobre preskúmané sú baktérie P. gingivalis a F. nucleatum- obe podporujú tvorbu zápalových cytokínov, proliferáciu (bujnenie) a inváziu buniek, každá iným spôsobom. Prvá vyvoláva podľa doktora Pereru napríklad tvorbu interleukínov (látok, ktorými komunikujú hlavne leukocyty medzi sebou), faktor nádorovej nekrózy a inhibuje apoptózu (potláča programovanú bunkovú smrť). Taktiež potláča aktivitu p53 nádorového supresorového génu (rozhoduje o zastavení/spustení bunkového cyklu produkciou proteínu p53, ktorý kontroluje, či DNA nie je poškodená). Neustále vystavenie P. gingivalis tiež zvyšuje invazivitu karcinómu. F.nucleatum na druhej strane podporuje bujnenie buniek a produkciu interleukínov, ktoré podporujú inváziu tumoru a metastázy. Oba druhy tiež tvoria endotoxíny ako lipopolysacharidy, ktoré aktivujú produkciu cytokínov- jeden z hlavných faktorov pri zápale tvorenom baktériami a prispievateľ karcinogenézy.
Prepojenie na rakovinu iných častí tela
Keďže ústna dutina nie je od zvyšku tela izolovaná, bola preukázaná prítomnosť patogénov úst aj ďalej v tráviacom trakte. Najčastejšie cestujú slinami. Dysbióza úst býva najčastejšie spájaná s rakovinou pažeráka, žalúdka, pankreasu a čriev. Jeden z prípadov je kolorektálny karcinóm. Ako uvádza Flemer, v danom ložisku bola zistená prítomnosť vyššie spomenutých druhov ústnych baktérií(P. gingivalis, F. nucleatum spolu s T. denticola, P. intermedia, Streptococcus a Prevotella) , ktoré pravdepodobne narúšajú rovnováhu čriev vedúcu k dysbióze. Vyššia prítomnosť P. gingivalis, Porphyromonas, S. mitis a A. actinomycetemcomitans a prítomnosť parodontitídy v ústach celkovo podľa Fana zase zvyšuje riziko rakoviny pankreasu. Pri rakovine pažeráka je zvýšená prítomnosť T. forsythia a P. gingivalis. T. denticola, S. mitis, a S. anginosus boli tiež nájdené. Infekcia je zdrojom zápalu, ktorý podporuje zvýšenú proliferáciu buniek, ktorá podporuje onkogenézu. Baktérie majú tiež priamy rušivý vplyv na signálne cesty buniek. Môžu sa tiež v tumore nachádzať sekundárne, vplyvom zníženej imunitnej obrany v danej oblasti.
Zhrnutie
Je preukázané, že ústne baktérie majú vplyv na zdravie ústnej dutiny aj mimo nej. Patogénne baktérie majú priamy vplyv na imunitnú odpoveď človeka aj na signálne dráhy buniek (pri raste, delení, apoptóze) predchádzajúce vývoju karcinómu. Nakoľko je karcinogenéza komplexný proces trvajúci dlhú dobu, je náročné preukázať priamu súvislosť medzi baktériami ústnej dutiny a rakovinou. Avšak je preukázané, že niektoré druhy ako P. gingivalis a F. nucleatum môžu podporovať cesty, ktoré môžu spustiť rozvoj karcinómu. Je tiež dôležité spomenúť, že mikroorganizmy v ľudskom tele pracujú spoločne a jeden druh nie je zodpovedný za všetko. Ďalší výskum na úplné pochopenie komplexných mechanizmov karcinogenézy pri baktériách je potrebný.
Zdroje:
Michaud DS, Lu J, Peacock-Villada AY, Barber JR, Joshu CE, Prizment AE, et al Periodontal disease assessed using clinical dental measurements and cancer risk in the ARIC study. J Natl Cancer Inst. 2018 Aug;110(8):843–54. https://doi.org/10.1093/jnci/djx278[PubMed]0027-8874
Dewhirst FE, Chen T, Izard J, Paster BJ, Tanner AC, Yu WH, et al The human oral microbiome. J Bacteriol. 2010 Oct;192(19):5002–17. https://doi.org/10.1128/JB.00542-10[PubMed]0021-9193
Aas JA, Paster BJ, Stokes LN, Olsen I, Dewhirst FE. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol. 2005 Nov;43(11):5721–32. https://doi.org/10.1128/JCM.43.11.5721-5732.2005[PubMed]0095-1137
Yang CY, Yeh YM, Yu HY, Chin CY, Hsu CW, Liu H, et al Oral Microbiota Community Dynamics Associated With Oral Squamous Cell Carcinoma Staging. Front Microbiol. 2018 May;9:862. https://doi.org/10.3389/fmicb.2018.00862[PubMed]1664-302X
Perera M, Al-Hebshi NN, Speicher DJ, Perera I, Johnson NW. Emerging role of bacteria in oral carcinogenesis: a review with special reference to perio-pathogenic bacteria. J Oral Microbiol. 2016 Sep;8(1):32762. https://doi.org/10.3402/jom.v8.32762[PubMed]2000-2297
Flemer B, Warren RD, Barrett MP, Cisek K, Das A, Jeffery IB, et al The oral microbiota in colorectal cancer is distinctive and predictive. Gut. 2018 Aug;67(8):1454–63. https://doi.org/10.1136/gutjnl-2017-314814[PubMed]0017-5749
Fan X, Alekseyenko AV, Wu J, Peters BA, Jacobs EJ, Gapstur SM, et al Human oral microbiome and prospective risk for pancreatic cancer: a population-based nested case-control study. Gut. 2018 Jan;67(1):120–7.